Hva er titandioksid?
Hovedkomponenten i titandioksid er TIO2, som er et viktig uorganisk kjemisk pigment i form av et hvitt fast stoff eller pulver. Det er ikke giftig, har høy hvithet og lyshet, og regnes som det beste hvite pigmentet for å forbedre materialets hvithet. Det er mye brukt i bransjer som belegg, plast, gummi, papir, blekk, keramikk, glass, etc.

Ⅰ.Titandioksid industrikjedediagram:
(1) Oppstrøms av industrikjeden for titandioksid består av råvarer, inkludert ilmenitt, titankonsentrat, rutil, etc;
(2) Midtstrømmen refererer til titandioksidprodukter.
(3) Nedstrøms er bruksområdet for titandioksid.Titandioksid er mye brukt i forskjellige felt som belegg, plast, papirfremstilling, blekk, gummi, etc.

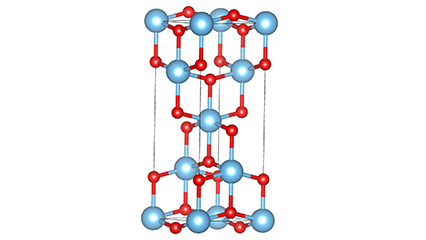
Ⅱ.Krystallstrukturen til titandioksid:
Titandioksid er en slags polymorf forbindelse, som har tre vanlige krystallformer i naturen, nemlig anatase, rutil og brookitt.
Både rutil og anatase tilhører det tetragonale krystallsystemet, som er stabile under normal temperatur; Brookite tilhører det ortorhombiske krystallsystemet, med ustabil krystallstruktur, så det har liten praktisk verdi i industrien for tiden.

Blant de tre strukturene er rutilfasen den mest stabile. Anatasefase vil irreversibelt transformeres til rutilfase over 900°C, mens brookittfase vil irreversibelt transformeres til rutilfase over 650°C.
(1) Rutilfase titandioksid
I rutilfase titandioksid er Ti-atomer plassert i midten av krystallgitteret, og seks oksygenatomer er plassert i hjørnene av titan-oksygen-oktaederet. Hvert oktaeder er koblet til 10 omgivende oktaedere (inkludert åtte delende hjørner og to delekanter), og to TiO2-molekyler danner en enhetscelle.
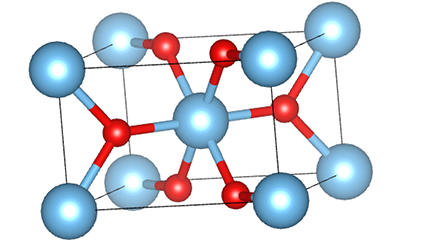
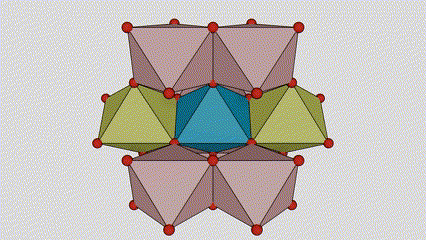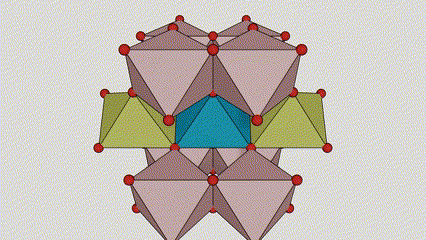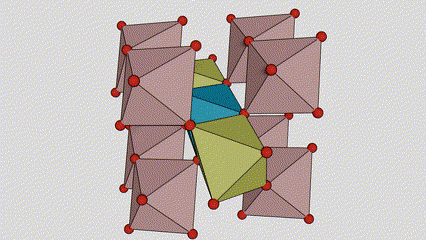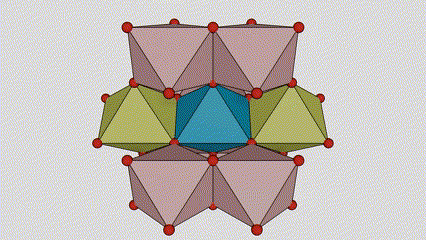
Skjematisk diagram av krystallcelle av rutilfase titandioksid (til venstre)
Tilkoblingsmetoden til oktaeder av titanoksid (til høyre)
(2)Anatasefase titandioksid
I anatasefase titandioksid er hvert titan-oksygen oktaeder koblet til 8 omgivende oktaeder (4 deler kanter og 4 deler toppunkter), og 4 TiO2 molekyler danner en enhetscelle.
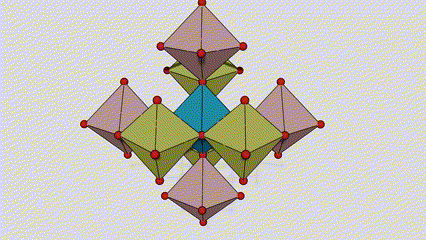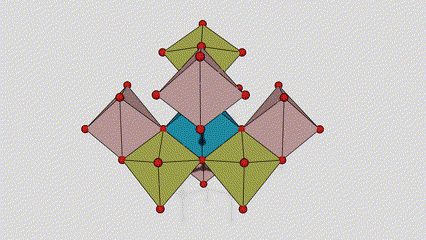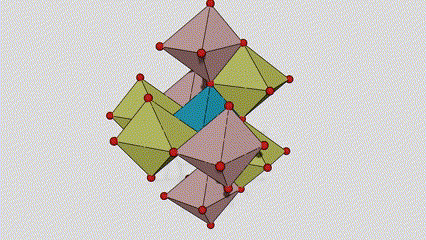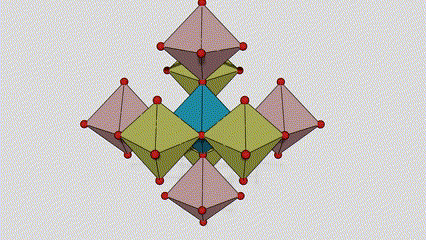
Skjematisk diagram av krystallcelle av rutilfase titandioksid (til venstre)
Tilkoblingsmetoden til oktaeder av titanoksid (til høyre)
Ⅲ. Fremstillingsmetoder for titandioksid:
Produksjonsprosessen av titandioksid inkluderer hovedsakelig svovelsyreprosess og kloreringsprosess.

(1)Svovelsyreprosess
Svovelsyreprosessen for titandioksidproduksjon involverer acidolysereaksjonen av titanjernpulver med konsentrert svovelsyre for å produsere titansulfat, som deretter hydrolyseres for å produsere metatitansyre. Etter kalsinering og knusing oppnås titandioksidprodukter. Denne metoden kan produsere anatase og rutil titandioksid.
(2)Kloreringsprosess
Kloreringsprosessen ved produksjon av titandioksid innebærer å blande rutil eller slaggpulver med høyt titanium med koks og deretter utføre høytemperaturklorering for å produsere titantetraklorid. Etter høytemperaturoksidasjon oppnås titandioksidproduktet gjennom filtrering, vasking med vann, tørking og knusing. Kloreringsprosessen for titandioksidproduksjon kan bare produsere rutilprodukter.
Hvordan skille ektheten til titandioksid?
I. Fysiske metoder:
(1)Den enkleste metoden er å sammenligne teksturen ved berøring. Falsk titandioksid føles jevnere, mens ekte titandioksid føles grovere.

(2)Ved å skylle med vann, hvis du legger litt titandioksid på hånden, er den falske lett å vaske av, mens den ekte er ikke lett å vaske av.

(3)Ta en kopp rent vann og slipp titandioksid i den. Den som flyter til overflaten er ekte, mens den som legger seg til bunnen er falsk (denne metoden fungerer kanskje ikke for aktiverte eller modifiserte produkter).
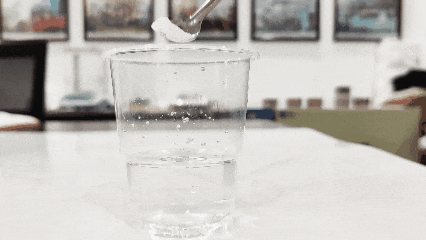

(4)Sjekk dens løselighet i vann. Generelt er titandioksid løselig i vann (bortsett fra titandioksid spesielt designet for plast, blekk og noe syntetisk titandioksid, som er uløselig i vann).

II. Kjemiske metoder:
(1) Hvis kalsiumpulver tilsettes: Tilsetning av saltsyre vil forårsake en kraftig reaksjon med en knirkende lyd, ledsaget av produksjon av et stort antall bobler (fordi kalsiumkarbonat reagerer med syre og produserer karbondioksid).

(2) Hvis litopon tilsettes: Tilsetning av fortynnet svovelsyre eller saltsyre vil gi en råtten egglukt.

(3) Hvis prøven er hydrofob, vil tilsetning av saltsyre ikke forårsake en reaksjon. Men etter å ha fuktet den med etanol og deretter tilsatt saltsyre, hvis det dannes bobler, beviser det at prøven inneholder belagt kalsiumkarbonatpulver.

III. Det er også to andre gode metoder:
(1) Ved å bruke den samme formelen PP + 30 % GF + 5 % PP-G-MAH + 0,5 % titandioksidpulver, jo lavere styrken til det resulterende materialet er, desto mer autentisk er titandioksidet (rutilet).
(2) Velg en gjennomsiktig harpiks, for eksempel gjennomsiktig ABS med 0,5 % titandioksidpulver tilsatt. Mål lystransmittansen. Jo lavere lystransmittansen er, jo mer autentisk er titandioksidpulveret.
Innleggstid: 31. mai 2024





